Biokimia Nutrisi (Darah)
Tinjauan Pustaka
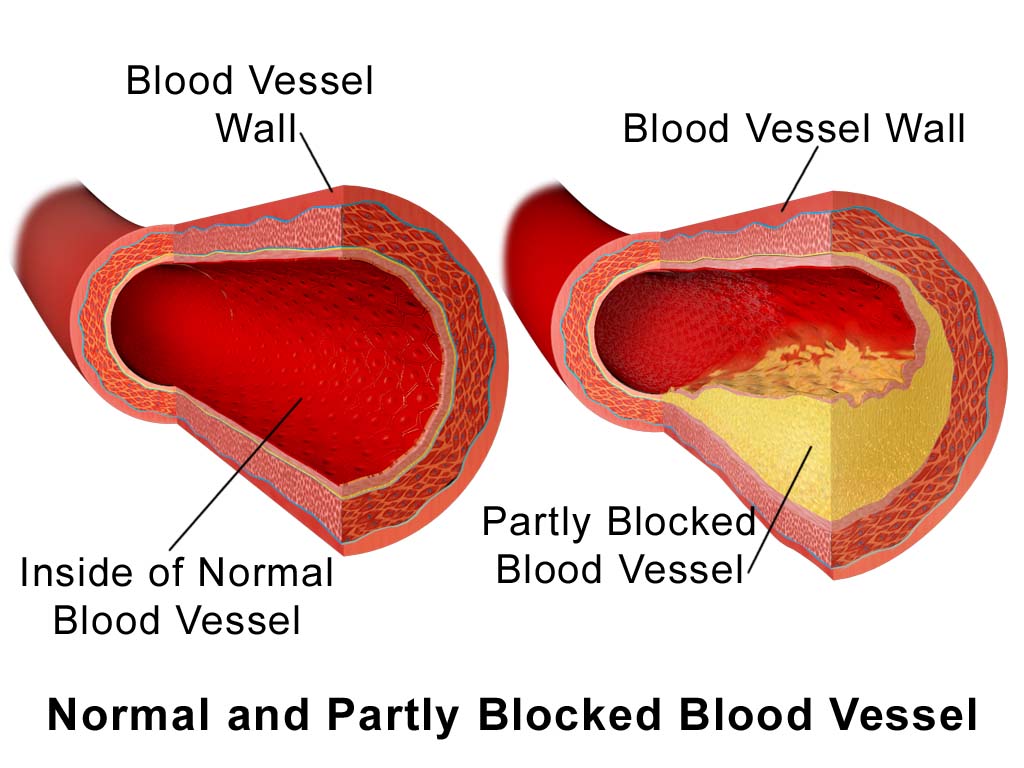 |
| Klik gambar untuk memperbesar |
Darah terdiri dari plasma darah dan unsur seluler. Unsur-unsur seluler
tersebut terdiri dari sel darah merah, sel darah putih dan keeping darah.
Sel darah merah sering disebut eritrosit, sel darah putih disebut leukosit,
sedangkan keping darah sering disebut trombosit. Darah memiliki beberapa fungsi
yaitu: membawa nutrien yang telah disiapkan oleh saluran pencernaan menuju
jaringan tubuh, membawa oksigen dari paru-paru ke jaringan, membawa
karbondioksida di jaringan ke paru-paru, membawa
produk buangan dari berbagai
jaringan menuju ginjal untuk diekskresikan, membawa kelenjar hormon endokrin ke
organ-organ lain di dalam tubuh, berperan dalam pengendalian suhu dan berperan
dalam mempertahankan keseimbangan air. (Frandson, 1992).
Fase cair yang tertinggal pada saat darah membeku (mengalami koagulasi)
dinamakan serum. Serum tidak lagi mengandung faktor pembekuan (termasuk
fibrinogen) yang normalnya terdapat di dalam plasma tetapi sudah terpakai dalam
proses koagulasi (Murray, 1999).
Cara memperoleh serum yaitu darah dibiarkan 15 menit agar menjendal
sehingga fibrinogennya tidak terdapat dalam cairan darah kemudian disentrifuge
dan didapatkan serum (Dawiesah, 1988).
Enzim dalam darah dikelompokkan menjadi enzim yang fungsional dan enzim
yang non fungsional. Enzim yang fungsional adalah enzim yang substratnya
terdapat dalam darah contohnya lipoprotein lipase, sedangkan enzim yang non
fungsional dalam darah dengan sendirinya tidak berfungsi dalam darah artinya
substratnya tidak ada dalam darah (Girindra, 1988).
Kadar glukosa darah dapat dipengaruhi oleh beberapa factor diantaranya
adalah umur, kadar energi pakan dan kondisi stres. Stres pada ayam petelur
dapat disebabkan oleh kondisi kandang yang kurang nyaman. Pada kondisi stres,
sekresi costicosterone meningkat sebagai akibat dari aktifitas
adrenocorticotropic hormone (ACTH) (Peebles et al., 1997).
Kandungan kolesterol dalam darah ayam berkisar antara 102 sampai 123 mg/100
ml (Ramanoff, 1983). Peningkatan kadar kolesterol dalam darah merupakan faktor
utama penyebab terjadinya atheroskerosis (Pelkonen et al., 1977 ;
Winarno 1984). Konsumsi lemak makanan terutama lemak jenuh dan kolesterol
merupakan salah satu faktor yang mempengaruhi konsentrasi kolesterol dalam
serum (Martin, 1983).
Materi dan Metode
Materi
Alat. Alat yang digunakan pada praktikum darah ini adalah
tabung reaksi dan raknya, pipet tetes, alat penggojok, spektofotometry,
waterbath, gelas ukur.
Bahan. Bahan yang digunakan dalam praktikum darah antara lain
larutan protein standar, plasma danblanko, larutan lowry ß-1,4-glukanase, lowry
A, aquades, plasma darah, Ba(OH)2 0,3 N, ZnSO4 5%,
glukosa anhidrat, reagensia nelson, arsenol molibdat, Cu2O, larutan
aseton alkohol, khloroform, asam sulfat pekat, asetat anhidrit.
Metode
Penentuan
Kadar Protein Darah (Metode Lowry)
Menyiapkan tiga tabung reaksi yang
masing-masing diisi 0,5 ml larutan protein standar, plasma dan blanko.
Ditambahkan ke dalam masing-masing tabung 2,5 ml larutan lowry B, divortex dan
dibiarkan 10 menit. Kemudian, ditambahkan larutan lowry A 0,25 ml, divortex dan
biarkan 30 menit. Lalu, dibaca pada panjang gelombang 570 nm dan dihitung
dengan menggunakan rumus:
Kadar protein = (Abs sampel/Abs
standar) x kadar protein standar x pengenceran
Penentuan
Kadar Glukosa Darah (Metode Nelson-Somogyi)
Tahap Pengendapan Protein.
Meletakkan 0,5 ml plasma darah ditambah 1,5 ml aquades ditambah 1,5 ml Ba(OH)2
0,3 N ditambah 1,5 ml ZnSO4 5% dan digojok. Kemudian, disentrifuge
pada 3000 rpm selam 15-20 menit. Lalu supernatan yang dihasilkan digunakan
untuk percobaan tahap penentuan glukosa.
Tahap Penentuan Glukosa.
Membuat larutan glukosa standar (10 mg glukosa anhidrat/100 ml (BM=180), karena
memakai glukosa monohidrat (BM=198) maka 11 mg glukosa/100 ml). Lalu dari
larutan glukosa standar, dilakukan beberapa pengenceran, sehingga diperoleh
larutan glukosa dengan konsentrasi 2,4,6,8 dan 10 mg/ 100 ml larutan. Disiapkan
7 buah tabung reaksi, 5 buah tabung diisi larutan standar, 1 tabung diisi
sampel dan 1 tabung diisi blanko, masing-masing sebanyak 1 ml. Lalu,
ditambahkan ke dalam masing-masing tabung 1 ml reagensia nelson dan dipanaskan
pada penangas air mendidih selama 20 menit. Diambil dan didinginkan secara
bersama-sama pada air dengan suhu ruang (25 °C). Setelah semua endapan Cu2O
larut sempurna dengan penambahan 1 ml arsenol molibdat, ditambahkan 7 ml
aquades dan divortex. Kemudian dibaca pada panjang gelombang 540 nm. Dibuat
kurve standar dan ditentukan kadar glukosa.
Pentuan Kadar Kholesterol Darah.
Dimasukkan dalam tabung sentrifuge yang berisi 10 ml larutan aseton alkohol
(1:1) 1 ml sampel, tabung direbus hingga larutan mendidih. Disentrifuge 3000
rpm selam 15 menit, supernatan diambil kemudian diuapkan pada waterbath
mendidih hingga tinggal residunya. Dilakukan pengenceran dengan khloroform. Residu
ditambah 2 ml khloroform ditambah 2 ml campuran (asam sulfat pekat : asetat
anhidrit = 1 : 30), divortex. 2 ml larutan standar (2 mg kholestrol /1 ml
khloroform) ditambah 2 ml campuran asam sulfat pekat dan asetat anhidrit,
divortex. Blanko: 2 ml khloroform
ditambah 2 ml campuran sulfat pekat dan asetat anhidrit, divortex. Dimasukkan
ke dalam ruang gelap. Lalu, dibaca pada panjang gelombang 680 nm setelah warna
berubah menjadi hijau dalam waktu 10 menit. Kemudian
dimasukkan dalam persamaan
Y = 0,034190303 +
26,861515 X, dan X dalam mg/100 mg (%).
Hasil dan Pembahasan
Penentuan
kadar glukosa darah
Tujuan praktikum ini adalah untuk
dapat mengetahui kadar glukosa darah pada ayam. Prinsip kerjanya adalah pada
sebuah tabung reaksi dituangkan sampel darah ayam ditambah dengan aquadest dan
Ba(OH)2 0,3 N, kemudian
divortexs. Tujuan dari divortexs ini adalah untuk membentuk filtrat Zn barium
pada Ba(OH)2. Kemudian
ditambah dengan ZnSO4 5% dan
diaduk, lalu disentrifuge pada 3000 rpm selama 15 menit untuk memisahkan
endapan dengan filtratnya. Kemudian blanko dibuat dengan cara yang sama dan
mengganti sampel dengan aquadest. Dibuat larutan induk glukosa dengan kadar 10 mg/100 ml kemudian
dibuat larutan standar. Kemudian ditambah dengan reagen nelson dan di vortex,
lalu dipanaskan salama 20 menit dan didinginkan. Hasilnya terdapat endapan biru
muda. Fungsi penambahan reagen nelson adalah untuk mengetahui adanya Cu dalam
darah yang akan membentuk reaksi warna pada glukosa. Kemudian ditambah dengan
arseno molibdat dan di vortex, ditambah dengan H2O dan divortex kembali dan diukur absorbansinya dengan
menggunakan spektrofotometer pada panjang gelombang 560 nm. Pada saat
penambahan reagen arsenomolibdat terjadi perubahan warna menjadi hijau
kekuning-kuningan. Uji ini positif jika berwarna biru. Dari hasil penelitian
menunjukkan warna kekuning-kuningan yang berarti uji tersebut negatif. Hasil
yang didapat kadar glukosanya yaitu 1,39691578 mg/ml dengan absorbansi 0,123.
Menurut Peebles et al.,
(1997), kadar glukosa darah dapat dipengaruhi oleh beberapa faktor yang antara
lain adalah umur, kadar energi pakan, dan kondisi stress. Pada kondisi stress, sekresi
conticosterone meningkat sebagai akibat dari aktivitas adrenocorticotropic
hormone (ACTH). Menurut Palvadolpirod dan Thaxton (2000), bahwa
meningkatnya corticosterone dapat mengakibatkan kadar glukosa darah
meningkat sebagai akibat glukoneogenesis. Kadar glukosa darah pada ayam menurut
packham (1982), berkisar antara 200 mg/100 ml-250 mg/100 ml.
Penentuan
kadar protein darah
Tujuan dari praktikum ini adalah
untuk mengetahui kadar protein darah yang terkandung dalam darah ayam. Prinsip
kerjanya adalah dengan disiapkan tabung reaksi diisi dengan aquadest untuk
blanko dan dua tabung diisi dengan plasma darah dengan pengenceran 600 kali.
Dilakukan pengenceran supaya absorbansinya dapat terbaca. Kemudian ditambah
dengan reagen lowry B, divortex dan dibiarkan 10 menit.fungsi penambahan reagen
ini adalah untuk mengikat N dalam protein darah karena mengandung sejumlah CuSO4. Kemudian ditambah reagen
lowry A, di vortex dan dibiarkan selama 30 menit. Fungsi penambahan reagen ini
adalah untuk mengoksidasi asam amino tirosin. Lalu pada menit ke 30 dibaca pada
panjang gelombang 750 nm. Hasilnya warna menjadi biru. Jadi dapat dikatakan
bahwa uji ini positif karena mengandung protein darah. Kadar protein darah pada
praktikum ini adalah 101,6478 mg/ml dengan absorbansi 0,362.
Menurut Page (1985), bahwa protein
yang ada pada darah yaitu albumin, a
globulin, dan fibrinogen. Albumin berfungsi untuk mempertahankan tekanan
osmosit dalam jaringan sedangkan a globulin
berfungsi untuk membentuk sistim pertahanan terhadap protein aktin dan anti
gen. fibrinogern adalah begian dari plasma darahg yang berfungsi pada pembekuan
darah atau penggumpalan darah. Kadar normal protein darah pada ayam adalah
mengandung albumin berkisar antara 16-20 mg/dl, globulin 23-33 mg/dl,sehingga
totalnya adalah berkisar antara 40-52 mg/dl.
Penentuan
kadar kholesterol darah
Tujuan dari praktikum ini adalah
untuk menentukan kadar kholesterol dalam darah yang terkandung dalam darah
ayam. Prinsip kerjanya adalah tabung yang berisi plasma darah dan asetol
alkohol divortex kemudian disentrifuge 3000 rpm. Fungsi penambahan aseton
alkohol adalah untuk mengikat lemak yang ada. Larutan ini disentrifuge untuk
memisahkan endapan dengan filtratnya, kemudian divortex agar terbentuk filtrat.
Lalu tabung direbus sampai mendidih dan didinginkan sampai dingin dalam suhu
kamar. Kemudian disentrifuge 3000 rpm selama 15 menit. Fungsi direbus adalah
untuk memisahkan air dengan lemak. Supernatan dimasukkan dalam tabung dan
diinkubasi daqlam waterbath sampai seluruh aseton alkohol menguap. Residu dalam
tabung ditambah dengan khloroform dan divortex. Fungsi dari penambahan
khloroform adalah untuk mempercepat reaksi. Larutan kholesterol dalam
khloroform diencerkan dengan campuran asam sulfat dengan asetat anhidrat dengan
perbandingan 1:30. Fungsi dari pengenceran adalah untuk memisahkan darah dengan
lemak dan untuk memecah ikatan khloroform. Blako dibuat dengan menggunakan
campuran 2 ml khloroform dengan asetat anhidrat. Tabung ditempatkan dalam ruang
gelap selama kurang lebih 15 menit sampai terbentuk warna hijau. Kemudian
dibaca absorbansinya pada panjang gelombang 680 nm. Kadar kholesterol dalam
praktikum ini didapat 1,82579.10¯³mg/ml, dengan absorbansi 0,084.
Kandungan kholesterol pada darah
ayam adalah berkisar antara 102-123 mg/100ml (Romanof, 1983). Konsentrasi
kholesterol dalam serum bervariasi dipengaruhi oleh umur, jenis kelamin, pakan,
total energi, temperatur lingkungan,konsentrasi kholesterol dalam bahan pakan
(William, 1974)
Menurut Poole et al., (1987),
bahwa konsentrasi kholesterol yang tinggi dalamdarah dapat menyebabkan
pembentukan endapan pada pembuluh darah yang dapat menyebabkan penggerusan
arteri sehingga tekanan darah menjadi tinggi. Sedangkan menurut martin et al.
(1983), bahwa konsumsi lemak makanan terutama lemak jenuh dan kholesterol dapat
menjadi salah satu faktor yang mempengaruhi konsentrasi kholesterol dalam
serum.
Penentuan
kadar kreatinin
Tujuan dari praktikum ini adalah
untuk mengendapkan kreatinin dalam darah. Prinsip kerjanya adalah dengan
mencampurkan 4 ml plasma dengan campuran tungstat-sulfat 0,5 N dengan
perbandingan 1:8, dan disentrifuge selama 15 menit. Kemudian filtrat dibagi
menjadi dua, kemudian ditambah dengan larutan standar dan campuran dari asam
pikrat jenuh dengan NaOH 10% dengan perbandingan 5:1. Kemudian divortex dan
dibiarkan pada suhu kamar selama 15 menit dan dibaca pada panjang gelombang 520
nm. Asam pikrat jenuh ini bereaksi dengan NaOH membentuk kreatinin pikrat dan
uji positif akan membentuk warna jingga. Dari hasil praktikum kadar kreatinin
adalah 0,015466034 n mol/ml
dengan absorbansi 0,035. Menurut Harper et al., (1980), bahwa kadar
kreatinin dalam serum atau darah sebesar 0,7 sampai1,5 ml/dl sedangkan menurut
Swenson (1993), bahwa kadar kreatinin dalam darah ayam adalah berkisar antara 1
sampai 2 ml/dl.
Kesimpulan
Dari hasil praktikum dapat disimpulkan bahwa kadar glukosa darah pada ayam
adalah 1,39691678 mg/ml dengan absorbansi 0,123. Kadar pratein darahnya adalah
0,03538 mg/ml dengan absorbansi 0,362. Kemudian kadar kholesterol darahnya
adalah 0,00182579 mg/ml dengan absorbansi 0,165. Sedangkan kadar kreatinin
darahnya adalah 0,015466034 n mol/ml
dengan absorbansi 0,035.
Tinggi rendahnya glukosa darah, kreatinin darah, protein darah dipengaruhi
oleh umur, kandungan energi pakan, jenis kelamin, dan kondisi stress. Sedangkan
kadar kholesterol darah dipengaruhi oleh umur, konsenterasi lemak makanan,
total energi makanan, dan temperatur lingkungan.
Lampiran
Perhitungan
Penentuan kadar glukosa darah
Absorbansi = 0,123
Y = 0,00524+0,0843 X
0,123 = 0,00524+0,0843 X
X = 0,11776
0,0843
= 1,39691578 mg/ml
Penentuan kadar protein darah
Absorbansi = 0,362
Y = 0,33+1,942 X
X = y-0,033 . 600
1,942
= 0,362-0,033 . 600
1,942
= 101,6478 mg/ml
Penentuan kadar kholesterol darah
Absorbansi = 0,084
Y = 0,36+1,942 X
X = y - 0,036
26,29
= 0,00182579 mg/ml
Penentuan kadar kreatinin darah
Absorbansi = 0,035
Filtrat = 1 ml
Pemekatan = 2,5
Filtrat
= 2,5/1 = 2,5
Y = 0,0222+0,33104921 X
X = y - 0,0222
0, 331049
= 0,038665087 ? mg/ml
Kreatinin = 
= 0,015466034
Daftar Pustaka
Borgman, R. F. and F.
Wardlow. 1985. Serum Cholesretol Consentration and Cholithiasic in Rabbit as
Influenced by Diatory.
Dawieasah, S. 1988. penentuan Nutrien dalam Jaringan dan Plasma Darah. UGM. Yogyakarta.
Frandson, R. D. 1992. Anatomi dan Fisiologi Ternak. Edisi keempat. Gadjah
Mada University Press. Yogyakarta.
Girindra, A. 1988. Biokimia Patologi Hewan. Pusat Antar Universitas IPB
bekerjasama dengan Lembaga Sumber Daya Informasi IPB. Bogor.
Harper, H A. Rodwell,
V W. D A Mayes. 1980. Biokimia Review of BiologicalChemistry. Lange Medical
Publication. California.
Martin, D. W., P.A.
Mayer and V. W. Rodwell. 1993. Biokimia. 19th ed. EGC. Jakarta.
Murray, R. K. 1999. Biokimia. Edisi 24. Penerbit buku
Kedokteran EGC. Jakarta.
Packam, R. G. 1982.
Feed Composition, Formulation and Poultry Nutrition A Courie Manual and Growth.
Australian University International Development Program (AUIDP). Australian
Vice Chancelors Comm. Sydney.
Page, D. S. 1985. Prinsip-Prinsip Biokimia. Edisi kedua. Erlangga.
Jakarta.
Peebles, E. D. A, A.
L. Pond., J. R. Thompson., C. D. Mc Daniel., N. M. Cox and M. A. Latour. 1997.
Haloxonp Attenuates serum corticosterone and augments serum glucose
concentrations in broiler stimulated with adrenocorticotropin. Poultry
Science.
Pelkonen, R. E., E. A. Nikkila., S. Kaskonen., K. Penttinen and S.
Saria1887. Asociation of
Serum Lipids and Obesity With Cardiovaskuler Mortality. Br Med. J. 2: 1185.
Poole, Jr W. J., S. R.
Shimer., Dunlop and W. E. Urban Jr. 1987. Effects of Methionine Suplementation
on Experimental Artherusclerosis in Rabbit. New York.
Puvadolprilod, S and
J. E. Thaxton. 200. Model of Physilogical Stress in Chickens 4.Digestion and Metabolism.
Poultry Science.
Romanoff, A. L and A.
J. Romanoff., 1993. The Avian Egg. 2nd Editon.John Willey AndSons,
Inc. New York.
Soliman, K. F. A. and
T. M. Huston. 1984.Effect of dietary protein and fat on the plasma cholesterol
and packed cell volume of chicken exposed to different environment temperature.
Poultry Science. 53; 161-166.
Swenson, M. S. 1993.
Physilogical Property and Chemical Constituen of Blood, in Dukes Physology of
Domestic Animal. 9th Ed. Comstock Publising Asosiates A Division of
Corneil University Press. London.
Williams, R. H. 1984.
Text book of Endocrinology. 5th ed. W. B. Soonders Co. Philadelphia.
London.
Comments
Post a Comment