Biokimia Dasar (Protein)
Tinjauan
Pustaka
 |
| Klik gambar untuk memperbesar |
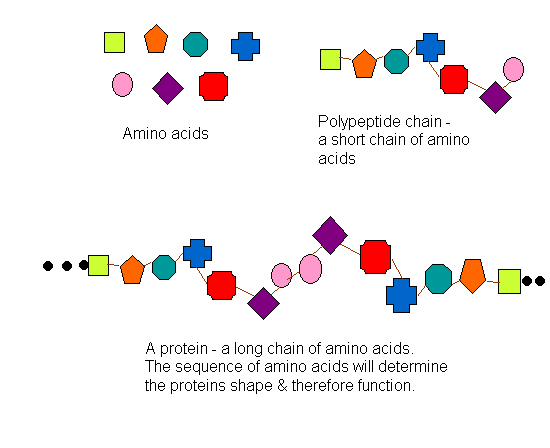
Pengertian Protein (akar kata protos dari bahasa
Yunani yang berarti “yang paling utama”) adalah senyawa organik kompleks
berbobot molekul tinggi yang merupakan polimer dari monomer-monomer asam amino
yang dihubungkan satu sama lain dengan ikatan peptida. Molekul protein
mengandung karbon, hidrogen, oksigen, nitrogen dan kadang kala sulfurfosfor.
Protein berperan penting dalam struktur dan fungsi semua selvirus. serta
makhluk hidup dan kebanyakan protein merupakan enzim atau subunit enzim.
(Nugraha, 2009).
Protein berasal dari bahasa Yunani proteios yang
berarti pertama atau utama. Protein merupakan makromolekul yang menyusun lebih
dari separuh bagian dari sel. Protein menentukan ukuran dan struktur sel,
komponen utama dari sistem komunikasi antar sel serta sebagai katalis berbagai
reaksi biokimia di dalam sel. Karena itulah sebagian besar aktivitas penelitian
biokimia tertuju pada protein khususnya hormon, antibodi dan enzim. (Kurniawan,
2007).
Protein berasal dari kata "proteios" yang
berarti "pertama" atau "kepentingan primer". Protein
merupakan senyawa organik yang sebagian besar unsurnya terdiri atas karbon,
hidrogen, oksigen, nitrogen, sulfur dan fosfor. Ciri khusus protein adalah
adanya kandungan nitrogen. Berdasarkan bentuknya, protein dapat
diklasifikasikan dalam tiga bagian, yaitu protein berbentuk bulat, serat dan
gabungan ke duanya. (Widodo, 2005).
Protein merupakan zat gizi yang tersusun atas asam amino
dan memiliki peran penting bagi tubuh, baik sebagai sumber energi maupun
sebagai zat pembangun, termasuk membentuk otot pada tubuh. Masingmasing bahan
pangan mengandung protein dengan kualitas yang berbeda-beda, dipengaruhi oleh
kandungan asam amino penyusun protein dan daya cerna protein. (Haryanto, 2004)
Protein merupakan kelompok biomakromolekul yang sangat
heterogen. Ketika berada di luar makhluk hidup atau sel, protein sangat tidak
stabil. Untuk mempertahankan fungsi dan nya, setiap jenis protein membutuhkan
kondisi tertentu ketika diekstraksi dari normal biological
milieu. Protein yang
diekstraksi hendaknya dihindarkan dari prosteolisis atau dipertahankan
aktivitas enzimatiknya. (Suhardjo, 2000)
Materi
dan Metode
Materi
Alat. Alat yang
digunakan dalam praktikum ini antara lain tabung reaksi, gelas ukur, pipet
tetes, pengaduk, penjepit, lampu spirtus dan penangas air mendidih.
Bahan. Bahan yang
digunakan dalam praktikum ini antara lain albumin, kasein, (NH4)2SO4, ZnSO4, HgSO4, NaNO3, HNO3, CuSO4, NaOH, NH4OH, H2O, KOH, klorofenol red, asam sulfosalisilat, larutan
esbasch, kal.ferosianida, asam wolframat, serum encer, asam asetat glasial,
formaldehid encer dan brom kresol hijau.
Metode
Uji Pengendapan dengan logam berat.
2 tabung reaksi masing-masing diisi dengan 2 ml larutan
albumin dan 1ml larutan kasein. Kemudian pada masing-masing larutan ditambahkan
ZnSO4, sehingga masing-masing larutan tampak berwarna putih. Lalu
pada masing-masing larutan ditambahkan ZnSO4 berlebih sehingga kedua larutan
tersebut larut membentuk Zn Albuminat (proteinat) dan Zn kaseinat.
Uji pengendapan dengan dengan alkaloid.
4 tabung reaksi masing-masing diisi dengan 2 ml larutan
albumin. Kemudian ke dalam tabung 1 ditambahkan 5 tetes asam sulfosalisilat,
tabung 2 ditambahkan 2 ml larutan esbasch, tabung 3 ditambahkan kal.ferosianida
dan asam asetat glasial sedangkan pada tabung 4 ditambahkan 20% asam wolframat.
Kemudian pada masing-masing larutan diamati dan dicatat perubahan yang terjadi.
Uji pengendapan dengan garam netral dan alkohol.
Ke dalam 2 tabung reaksi masing-masing diisikan larutan
albumin. Kemudian pada tabung 1 ditambahkan (NH4)SO4 padat dan pada tabung 2 ditambahkan 2 ml alkohol pekat.
Setelah larutan tampak berwarna putih, lalu masing-amsing larutan diencerkan
dengan penambahan H2O (akuades). Kemudian diamati
perubahan yang terjadi.
Uji Biuret (ikatan peptida).
Ke dalam sebuah tabung reaksi diisi dengan 2 ml larutan
albumin, 2 ml KOH 10% atau NaOH 10% dan beberapa tetes CuSO4 0,1%. Kemudian larutan tersebut dicampur sehingga larutan
tampak berwarna ungu.
Uji Milon (aa tirosin).
Ke dalam tabung reaksi diisi 2 ml larutan albumin dan 1 ml
larutan HgSO4 kemudian dicampur dan dipanaskan diatas sumbu
selama 10 menit. Setelah dingin, ditambahkan 5 tetes NaNO3 kemudian dipanaskan
selama 10 menit. Lalu diamati perubahan yang terjadi.
Uji Hopskin-Cole (aa triptophan).
Ke dalam tabung reaksi diisi 1 ml larutan albumin dan 1 ml
larutan formaldehid encer ditambah H2SO4 pekat lewat dinding tabung kemudian digojog. Lalu diamati
perubahan yang terjadi.
Uji Xanthoprotein (aa aromatik).
Ke dalam tabung reaksi diisi 3 ml larutan albumin dan 1 ml
larutan asam nitrat pekat kemudian dicampur dan dipanaskan diatas spiritus
selama 10 menit. Setelah dingin, ditambahkan 5 tetes NH4OH. kemudian diamati perubahan yang terjadi.
Uji Molisch (identifikasi gugus karbohidrat).
Ke dalam tabung reaksi diisi ml larutan albumin dan 2 ml
larutan reagen molisch ditambah HNO3pekat lewat
dinding tabung kemudian digojog. Lalu diamati perubahan yang terjadi.
Pengujian protein berdasarkan kelarutan (albumin danglobulin).
Ke dalam 2 tabung masing-masing diisi dengan 2 ml serum
encer. Tabung 1 ditambahkan 2 tetes asam sulfosalisilat, sedangkan tabung 2
ditambahkan 1 tetes klorofenol red dan diteteskan asam asetat 2% hingga warna
larutan hilang. Kemudian larutan tersebut dipanaskan sampai terjadi endapan,
lalu didinginkan. Selanjutnya dibagi menjadi 2. Tabung 1 ditambahkan 2 ml asam
nitrat dan tabung 2 ditambahkan 2 ml Na2CO3 encer. Kemudian diamati perubahan yang terjadi.
Pengujian terhadap kasein.
Ke dalam tabung reaksi diisi dengan 5 ml larutan kasein dan
dicampur dengan aquades, 2 ml NaOH encer, 2 tetes asam asetat dan brom kresol
hijau. Kemudian diamati perubahan yang terjadi.
Uji Neuman terhadap kasein.
Ke dalam sebuah tabung reaksi diisi dengan 5 ml larutan
kasein cair , 5 ml 10 tetes H2SO4 pekat dan 5 tetes HNO3. Kemudian
larutan tersebut dicampur dan dipanaskan diatas api kecil sambil digoyang
sehingga keluar asap putih. Setelah itu, larutan dinginkan dan ditambahkan
amonium molibdat lalu dimasak selama 10 menit. Selanjutnya diamati perubahan
yang terjadi.
Penggujian terhadap gelatin.
Ke dalam tabung reaksi diisi 1 sendok gelatin padat dan
dilarutkan dalam 10 ml larutan aquades. Kemudian dopanaskan dalam penangas air
mendidih. Lalu didinginkan dan diuji warna dengan biuret, milon, hopskincole,
xanthoprotein dan molisch.
Uji Reaksi Pengendapan.
Ke dalam 2 tabung reaksi masing-masing diisi dengan 5 ml
larutan gelatin. Tabung 1 ditambahkan amonium sulfat padat dan tabung 2
ditambahkan kal.ferosianida dan beberapa tetes asam asetat. Kemudian diamati
perubahan warna.
Hasil dan Pembahasan
Pada percobaan ini, dilakukan uji pengendapan pada protein
dengan menggunakan logam berat yaitu dengan menambahkan ZnSO4 pada larutan
albumin dan kasein. Dari percobaan yang dilakukan, masing-masing larutan yang
ditambahkan ZnSO4 mula-mula berwarna putih dan membentuk endapan, namun setelah
penambahan ZnSO4 berlebihan masing-masing endapan tersebut kemudian menjadi
larut. Hal ini terjadi karena penambahan ZnSO4 telah lewat jenuh menyebabkan
protein telah lewat titik isolistriknya dan ikatan Zn dengan protein terlepas
sehingga endapan tersebut menjadi larut membentuk Zn Albuminat (proteinat) dan
Zn Kaseinat.
Untuk mengetahui terjadinya pengendapan pada protein juga
dilakukan pengujian dengan mereaksikan albumin dengan alkohol dan garam netral.
Dari percobaan yang dilakukan, pada saat albumin direaksikan dengan (NH4)2SO4 larutan
berwarna putih begitu juga dengan albumin yang direaksikan dengan alkohol juga
berwarna putih namun terdapat beberapa endapan. Setelah pada masing-masing
larutan ditambahkan akuades, endapan tersebut menjadi larut. Hal ini
membuktikan bahwa albumin larut dalam air dan garam encer tetapi tidak larut
dalam alkohol.
Pada uji Milon, albumin direaksikan dengan HgSO4 dan dipanaskan 10 menit menghasilkan senyawa berwarna
putih. Kemudian setelah didinginkan, larutan albumin yang ditambahkan NaNO3 menghasilkan senyawa berwarna merah. Peristiwa ini terjadi
karena adanya ikatan Hg dengan gugus hidroksifenil dari aa tirosin. Hg
berikatan dengan NaNO3 membentuk HgNO3 dengan pemanasan membentuk endapan merah.
\
Pada Uji Hopskin-Cole, larutan albumin direaksikan dengan
formaldehid encer dan H2SO4 menghasilkan
larutan berwarna ungu. Hal ini terjadi karena adanya kondensasi antara gugus
aldehid dari formaldehid dengan gugus indol dari aa triptophan yang terdapat
pada albumin.
Pada uji xanthoprotein, albumin direaksikan dengan HNO3 dan dipanaskan 10 menit menghasilkan senyawa berwarna
kuning. Kemudian setelah didinginkan, larutan albumin ditambahkan NH4OH menghasilkan senyawa berwarna kuning pekat. Reaksi ini
disebabkan karena terjadi nitrasi pada inti benzena pada aa aromatik dengan
penambahan NH4OH.
Pada uji molisch, albumin direaksikan dengan reagen molisch
kemudian digojok dan ditambahkan H2SO4pekat lewat dinding sehingga larutan berwarna ungu. Warna
ungu tersebut terbentuk karena sakarida pada protein jika dipanaskan dengan
penambahan asam kuat akan terdehidrasi menjadi furfural dan apabila bereaksi
dengan alfa naftol atau timol dalam alkohol akan membentuk suatu senyawa yang
berwarna.
Untuk mengetahui macam-macam protein dilakukan pengujian
albumin dan globulin berdasarkan kelarutan. Laruran serum direaksikan dengan
asam sulfosalisilat berwarna putih, karena asam sulfosalisilat merupakan
alkaloid dengan gugus anion berikatan dengan serum encer yang bemuatan positif
sehingga membentuk endapan putih. Sedangkan pada serum yang ditambahkan
klorofenol red menghasilkan larutan berwarna merah, setelah penambahan asam
asetat berwarna bening (warna hilang). Setelah itu larutan dipanaskan sehingga
membentuk endapan lalu dibagi menjadi 2 tabung. Tabung 1 ditambahkan HNO3
berwarna kuning keruh, sedangkan tabung 2 ditambahkan Na2CO3 berwarna pink keruh karena
dengan penambahan garam endapan pada larutan tersebut menjadi larut.
Kasein direaksikan dengan akuades, brom kresol hijau dan
asam asetat menghasilkan senyawa berwarna kehijauan. Hal ini terjadi karena
asam asetat menyebabkan endapan kehijauan sehingga terjadi penurunan pH
mencapai titik isolistrik dan mengalami koagulasi. Sedangkan pada kasein yang
direaksikan dengan HNO3pekat dan H2SO4 menghasilkan asap putih,
setelah itu ditambahkan amonium miolibdat dan dipanaskan selama 10 menit menghasilkan
senyawa berwarna kuning membentuk amonium phospomolibdat. Hal ini terjadi
karena P dalam kaseim terlepas dengan penambahan HNO3 dan H2SO4 membentuk
HPO4 yang kemudian berikatan dengan amonium molibdat membentuk
amonium phospomolibdat.
Pada uji warna juga dilakukan dengan mereaksikan gelatin
dengan akuades, setelah itu dipanaskan dan diuji warna. Dengan uji biuret,
millon, hopskin-cole dan xanthoprotein menghasilkan senyawa berwarna bening,
karena gelatin tidak mampu bereaksi dengan uji warna tersebut. Sedangkan dengan
uji molisch, senyawa berwarna coklat pekat karena larutan gelatin mampu
terdehidrasi membentuk furfural dan senyawa berwarna.
Uji pengendapan pada gelatin dilakukan dengan mereaksikan
gelatin dengan amonium sulfat padat yang membentuk endapan putih karena amonium
sulfat padat dapat menetralkan sekaligus mendehidrasi sehingga membentuk
endapan. Sedangkan pada gelatin yang direaksikan dengan kalium ferosianida dan
asam asetat menghasilkan larutan berwarna kuning jernih tanpa ada endapan. Hal
ini tyerjadfio karena kalium ferosianida bersifat alkaloid dengan gugus amin
positif sedangkan gelatin gugus amin juga positif sehingga tidak mampu
terdehidrasi dan membentuk endapan.
Kesimpulan
Berdasarkan praktikum yang telah dilakukan dapat disimpulkan
bahwa albumin merupakan protein yang larut dalam air dan garam encer tetapi
tidak larut dalam alkohol, sehingga ketika direaksikan dengan alkohol, logam
berat, alkaloid dan membentuk endapan. Ketika direaksikan dengan beberapa uji
warna menghasilkan larutan dengan warna yang berbeda-beda sesuai prinsip kerja
masing-masing pereaksi, namun pada larutan gelatin yang direaksikan dengan uji
warna tidak ada perubahan warna yang tampak karna tidak terjadi reaksi
didalamnya. Gelatin yang direaksikan dengan garam padat membentuk endapan
sedangkan yang direaksikan dengan alkaloid (kalium ferosianida) tidak membentuk
endapan. Kasein yang direaksikan dengan brom kresol hijau dan asam asetat
mebentuk senyawa berwarna hijau sedangkan yang bereaksi dengan amonium molibdat
dan asam pekat membentuk senyawa berwarna kuning (amonium phospomolibdat).
Daftar Pustaka
Haryanto,setyawan.2004.Dasar-dasar Ilmu
Gizi.Semarang: UNDIP Press.
Kurniawan,hendra.2007.Makanan 4 sehat 5
sempurna.Jakarta: Cakrawala
Nugraha, ganjar. 2009. Arti Penting Gizi.
Surabaya :
Kartika Suhardjo. 2000. Prinsip-prinsip Ilmu
Gizi. Yogyakarta : Kanisius
Widodo,wahyu. 2005. Nutrisi dan Pakan Unggas.
Malang : UMM Press
Comments
Post a Comment