Biokimia Dasar (Lipida)
Tinjauan Pustaka
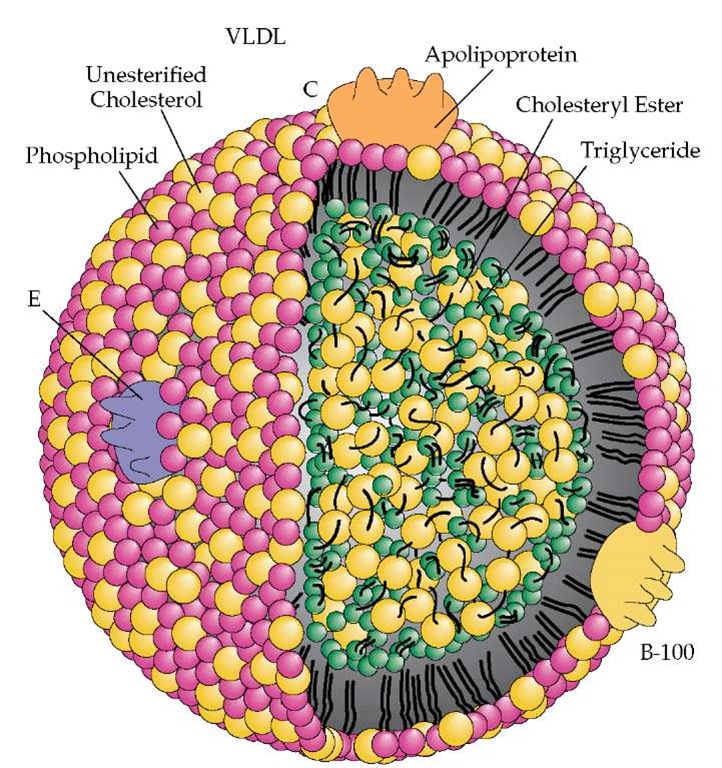 |
| Klik untuk memperbesar |
Lipida adalah senyawa organik berminyak
atau berlemak yang tidak larut didalam air, yang dapat diekstrak dari sel dan
jaringan oleh pelarut nonpolar, seperti khloroform atau eter. Jenis lipida yang
paling banyak adalah lemak atau triasilgliserol. Asam lemak merupakan komponen
unit pembangunan yang khas pada kebanyakan lipida. Asam lemak adalah asam
organik berantai panjang yang mempunyai atom karbon dart 4 sampai 24, memiliki
gugus karboksil tunggal dan ekor hidrokarbon nonpolar yang panjang yang
menyebabkan kebanyakan lipida bersifat tidak larut didalam air dan tampak
berminyak atau berlemak (Lehninger, 1982).
Lipida adalah semua substansi yang dapat
dieksiraksi dari bahan-bahan biologik dengan pelarut lemak (eter, kloroform,
benzena karbon, tetrakhlorida, aseton, dan lain-lain). Susunan dan fungsi
lipida pada tubuh hewan sangat bervariasi. Lipida mengandung unsur-unsur
karbon, hidrogen, dan oksigen sehingga merupakan sumber energi. Karena lipida
mengandung lebih banyak proporsi intra molekuler karbon dan hidrogen, tetapi
lebih sedikit oksigen dibanding karbohidrat, maka konsentrasi energinya adalah
relatif lebih tinggi. Lipida selain larut dalam lemak, juga membentuk ikatan
ester dari asam-asam lemak dengan berbagai alkohol (Poedjiadi, 1994).
Lemak adalah kumpulan zat-zai makanan
yang larut dalam eter, kloroform, benzena. Dalam analisa proksimat, lemak yang
diperoleh merupakan lemak kasar.
Perbedaan lemak
dan karbohidrat terutama terletak pada tingginya kandungan atom C dan H
dibanding dengan atom O dalam molekul (Parakkasi, 1983).
Asam
lemak adalah asam organik yang terdapat sebagai ester trigliserida atau lemak. Lemak
adalah suatu ester asam lemak dengan gliserol. Gliserol adalah trihidroksi
alkohol yang terdiri atas 3 atom karbon. Lemak yang mempunyai titik lebur
tinggi mengandung asam lemak jenuh. Sedangkan lemak cair (minyak) mengandung
asam lemak tidak jenuh. Lilin adalah ester asam lemak dengan monohidroksi alkohol
yang mempunyai rantal karbon panjang. Lilin tidak larut dalam air tetapi larut
dalam pelarut lemak (Poedjiadi, 1994).
Materi dan Metode
Materi
Alat. Alat yang
digunakan adalah tabung reaksi ,pemanas, penangas air mendidih, pipet, gelas
ukur, stopwatch, penjepit tabung reaksi, corong, lempeng tetes, kertas minyak,
biuret, labu ukur, Erlenmeyer.
Bahan.
Bahan yang digunakan adalah khloroform, eter, air, larutan 2% Na2CO3,
larutan empedu encer, minyak kelapa, pereaksi Hubl, minyak zaitun, minyak
jarak, sample, pelarut lemak, phenolptalein, 0,1N KOH, gliserol, NaHSO4,
tepung gandum, tepung kedelai.
Metode
Hal: Kelarutan dan terjadinya emulsi
Uji
kelarutan. Sebanyak 5 tabung reaksi disiapkan dan diisi
masing-masing dengan 2ml chloroform, eter, air, larutan 2% Na2CO3,
dan larutan empedu encer. Kemudian ke dalam tiap tabung ditambahkan setetes
rninyak kelapa. Digojok, kemudian dibiarkan selama 5 menit. Catat
perbedaan-perbedaan yang terjadi.
Hal: Ketidakjenuhan
Angka
Yod. Sebanyak 10ml khloroform dicampur dengan 10 tetes pereaksi Hubl,
kemudian isinya dituangkan ke dalam 4 tabung reaksi. Ke dalam masing-masing
tabung reaksi ditambahkan setetes minyak zaitun, minyak jarak, dan tabung
keempat ditetesi dengan minyak kelapa. Kemudian digojog dan amati perubahan
warnanya. Ditambahklan setetes demi setetes, bila warna merah muda itu belum
hilang. Catat berapa tetes minyak yang dipergunakan untuk menghilangkan warna
tadi.
Angka Asam. Sebanyak 10g
sampel ditimbang, kemudian sampel yang sudah dicairkan, dicampurkan ke dalam
50ml pelarut lemak. Kemudian ditambah dengan lml larutan phenolptalein dan
dihomogenkan (divortex). Dititrasi dengan 0,1N KOH sampai berwarna pink. Catat
jumlah mililiter alkali standar yang diperlukan dan hitung angka asam dari
lemak. Rumus perhitungan angka asam :
 |
| Klik untuk memperbesar |
Hasil dan
Pembahasan
Uji
kelarutan dan terjadinya emulsi. Tabung 1 menghasilkan warna bening
larut karena khloroform melarutkan lemak. Pada tabung kedua warna juga bening
karena eter melarutkan lemak. Tabung ketiga warna bening namun tidak larut
karena minyak tidak lanat dalarn air. Pada tabung 4 terjadi penyabunan karena
terjadi reaksi saponifikasi. Reaksi penyabunan:
H2 – C – O – C – C17H35
|
H2 – C – O – C – C17H35
+ 3NaOH à 3C17H35
– C + H2C – OH
|
| |
H2 – C – O – C – C17H35 ON4 HC – OH
|
H2C – OH
triasilgliserol basa gliserol
Pada tabung 5
terjadi emulsi karena fungsi garam empedu mengemulsi lemak sehingga mudah untuk
dipecah.
Uji angka yod. Campuran 9ml
khloroform + 9tetes pereaksi Hubl, dan larutan dibagi menjadi 3. Tabung
pertama larutan tersebut + minyak kelapa sampai warna merah muda hitang
memerlukan 30 tetes hingga warna bening. Tabung kedua ditambah 28 tetes minyak
jagung hingga warna bening. Dan pada tabung ketiga memerlukan 38 tetes minyak
hewan hingga warna menjadi jernih. Semakin sedikit tetesan, maka kemampuan mengadisinya
(iod) semakin besar, berarti ikatan rangkapnya semakin banyak dan semakin tidak
jenuh. Urutan kejenuhan: minyak jagung < minyak kelapa < minyak hewan
paling jenuh.
Uji akrolein (ketengikan).
Digunakan untuk mengetahui pengaruh KHSO4 terhadap dehidrasi
gliserol. Tabung kedua menghasilkan bau yang lebih tengik daripada tabung
pertama. Minyak tersusun dari triasil gliserol dan terpecah ketika diberi KHSO4,
gliserol mengalami dehidrasi karena KHSO4 bersifat hidroskopis
dan membentuk akrolein. Reaksi ketengikan: H2C
– C – OH CHO
| |
HC – OH KHSO4à CH + 2H2O | ||
H2C
– OH CH2
gliserol akrolein (bau khas)
Uji
angka asam. Digunakan 2 sampel yaitu mentega dan minyak kelapa. Pada
sampel mentega, jumlah ml 0,1N KOH yang diperlukan adalah 35ml. Kemudian dapat
dihitung angka asamnya dengan rumus : (ml titrasi x 5,6)/g sampel = mg KOH/g
sampel. Menghasilkan angka asam 196 mg KOH/g sampel. Pada sampel kedua yaitu
minyak kelapa jumlah ml 0,1N KOH yang dibutuhkan adalah 28ml, dan angka asamnya
156,8 mg KOH/g sampel. Semakin tinggi angka asam, maka KOH yang dibutuhkan
untuk menetralkan asam lemak bebas semakin banyak. Jadi mentega mengandung asam
lemak yang lebih besar daripada minyak kelapa.
Uji
noda lemak (ada/tidaknya lemak). Tabung pertama yang menggunakan tepung
gandum terdapat noda lemak lebih sedikit daripada tabung kedua yang menggunakan
tepung kedelai. Jadi tepung kedelai lebih banyak mengandung lemak daripada
tepung gandum.
DAFTAR PUSTAKA
Lehninger,
A.L. 1982. Dasar-dasar Biokimia. Erlangga, Jakarta.
Parakkasi,
A. 1983. Ilmu Gizi dan Makanan Ternak. Angkasa, Bandung.
Poedjiadi,
A. 1994. Dasar-dasar Biokimia. Universitas Indonesia, Jakarta.
Comments
Post a Comment